Imunohistoquímica (IHC) Protocolo general
I. Material necesario
Reactivos
- Un anticuerpo primario , etiquetada o no, contra la molécula diana
- Kit revelación
- Cromógeno
Búferes
- Xileno
- Baños alcohólicos al 70%, 80%y 95%.
- Peróxido de hidrógeno (H2O2)
- Tris EDTA, Tris HCl
- Tween-20
Material
- Pipetas y Pipet-aid
- Baño de agua
II. Duración de la experimentación
- 10 mn de bloqueo de peroxidasa
- 30 mn de recuperación antigénica
- 1 h de incubación del anticuerpo primario
- 10 mn de incubación del cromógeno
- 2 h de pasos de aclarado y baños
- TOTAL : 4 horas
III. Protocolo
- Desparafinar la sección en 3 cambios de xileno, 5 minutos cada uno.
- Lavar la sección en alcohol bencílico al 96%, 80% y 70% durante 5 minutos cada uno.
- Aclarar con agua destilada.
- Bloquear la peroxidasa endógena incubando el tejido en peróxido de hidrógeno (H2O2) al 3% durante 10 minutos.
- Lavar en agua destilada durante 5 minutos.
- Lavar en tampón 0,05 M Tris-HCl , pH 7,6 suplementado con 0,2% de Tween-20 (tampón A) durante 5 minutos.
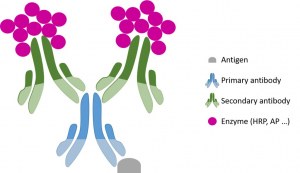
- Para productos concentrados: Incubar la sección con anticuerpo primario diluido en tampón A a la dilución 1:100 - 200 durante 1 hora en la cámara húmeda cerrada.
Para productos RTU: Incube la sección con el anticuerpo primario (listo para usar) durante 1 hora en una cámara húmeda cerrada.
- Lavar dos veces 5 minutos con tampón A.
- Aplicar el anticuerpo secundario (el protocolo depende del proveedor), y proceder al protocolo estándar de inmunohistoquímica (HRP - Peróxido - DAB).
- Lavar dos veces 5 minutos con tampón A.
- Aplicar el cromógeno (DAB), 10 minutos.
- Lavar en agua durante 10 minutos.
- Tinción con hematoxilina durante 5 minutos.
- Lavar en agua durante 10 minutos.
- Deshidratar la sección en 2 cambios de alcohol bencílico al 96% durante 5 minutos cada uno.
- Lavar la sección en 2 cambios de xileno durante 2 minutos cada uno.
- Monte el portaobjetos para su observación.

