NuSep
 |
||
NuSep offre una gamma completa di gel prefabbricati per l'elettroforesi delle proteine.
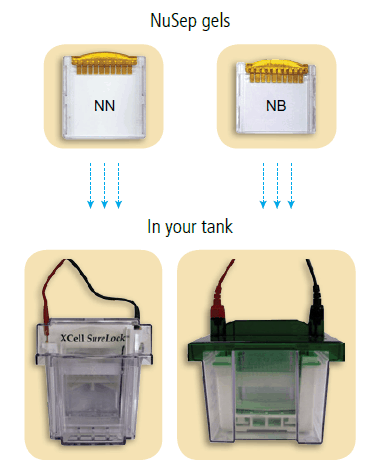
Compatibile con tutti i serbatoi da 10 cm
3 diversi tipi di gel per adattarsi a tutte le vasche:
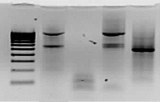
 Visualizzazione in 2 minuti tramite UV
Tutti i gel prefabbricati nUView incorporano una formulazione unica che consente di visualizzare le bande proteiche in soli 2 minuti in presenza di luce ultravioletta (UV). Ulteriori informazioni
Flessibilità di esecuzione in diversi sistemi tampone
I gel NuSep possono essere sviluppati in una gamma di tamponi Tris con diversi controioni, ognuno dei quali produce sottili variazioni nel modello di migrazione. Compatibile con i tamponi Tris-Glicina, MES e MOPS. 
Sito web: www.nusep.com
| ||
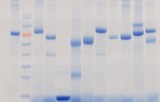
Elettroforesi delle proteine
L'elettroforesi delle proteine è una tecnica di elettroforesi su gel che consente di analizzare una miscela di proteine. Il gel utilizzato è composto da acrilammide, che polimerizza formando una rete. L'elettroforesi su gel consente di separare le proteine per l'analisi. Si basa sulla capacità delle proteine cariche di migrare attraverso le maglie di un gel quando viene applicata una corrente elettrica. L'analisi di una miscela mediante elettroforesi su gel viene effettuata sulle cosiddette proteine denaturate, cioè proteine che hanno perso le loro strutture terziarie e secondarie. Un detergente anionico ricopre le catene polimeriche denaturate, conferendo loro una carica (rapporto costante carica/aminoacidi). Le singole proteine di una miscela complessa sono così ricoperte da un "mantello" di cariche negative. Quando si applica una tensione continua tra le estremità di un gel in cui è stata depositata la miscela complessa di proteine, le proteine migrano attraverso le maglie che costituiscono il gel. Le maglie del gel tratterranno meno molecole a basso peso molecolare, che avranno quindi la migrazione maggiore. Le molecole più lunghe saranno trattenute maggiormente tra le maglie del gel e avranno una migrazione relativa inferiore. La definizione della separazione può essere aumentata o diminuita utilizzando un gel a maglie più o meno larghe. Durante la migrazione viene utilizzato un marcatore di peso molecolare per ottenere una scala di peso molecolare che consenta di determinare le dimensioni di ciascuna proteina presente nella miscela.
Per visualizzare le proteine dopo la migrazione, il più delle volte si utilizza una colorazione specifica. La colorazione più comunemente utilizzata è il blu di Coomassie, ma è anche possibile eseguire una colorazione all'argento. Durante la migrazione si utilizza un marcatore di peso molecolare per ottenere una scala di peso molecolare che consenta di determinare la dimensione di ciascuna proteina nella miscela.