NuSep
 |
||
NuSep propose une gamme complète de gels pré-coulés pour l'électrophorèse des protéines.
Compatibles avec les systèmes pour mini gels
3 types de gel différents pour convenir à tous les systèmes :
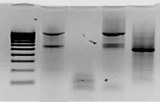
 Visualisation en 2 minutes par UV
Tous les gels précoulés nUView contiennent une formulation unique permettant la visualisation des bandes de protéine en seulement 2 minutes grâce à une lampe à ultraviolet (UV). Plus d'informations
Flexibilité - possibilité d'utiliser différents tampons de migration
Les gels NuSep peuvent être utilisés avec différents tampons Tris avec des profils de migration légèrement différents. Compatibles avec les tampons de migration : Tris-Glycine 
Site internet : www.nusep.com
| ||
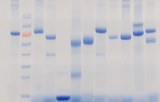
Electrophorèse des protéines
L'électrophorèse des protéines est une technique d'électrophorèse sur gel qui permet l'analyse d'un mélange de protéines. Le gel utilisé est composé d'acrylamide qui en polymérisant va former un réseau de mailles. L'électrophorèse sur gel permet de séparer les protéines afin de les analyser. En effet, elle repose sur la capacité des protéines chargées à migrer au travers des mailles d'un gel lorsqu'on applique un courant électrique. L'analyse d'un mélange par électrophorèse sur gel s'effectue sur des protéines dites dénaturées, c'est-à-dire ayant perdu leurs structures tertiaires et secondaires. Un détergent de type anionique recouvre les chaînes de polymère dénaturé en leur conférant une charge (rapport charge/acide-aminé constant). Les différentes protéines d'un mélange complexe se trouvent donc recouvertes d'un « manteau » de charges négatives. Lorsqu'on applique une tension continue entre les extrémités d'un gel où a été déposé le mélange complexe de protéines, les protéines migrent au travers des mailles constituant le gel. Les mailles du gel retiendront moins les molécules ayant un poids moléculaire faible qui auront alors la migration la plus grande. Les molécules les plus longues seront d'autant plus retenues entre les mailles du gel et auront une migration relative plus faible. On peut augmenter ou diminuer la définition de la séparation en utilisant un gel avec des mailles plus ou moins lâches. Un marqueur de poids moléculaire est utilisé lors de la migration afin de donner une échelle de poids moléculaires qui permettra de déterminer la taille de chaque protéine du mélange.
Afin de visualiser les protéines après migration, on utilise le plus souvent une coloration spécifique. La coloration la plus utilisée est le bleu de Coomassie mais il est également possible de réaliser une coloration à l'argent. Un marqueur de poids moléculaire est utilisé lors de la migration afin de donner une échelle de poids moléculaires qui permettra de déterminer la taille de chaque protéine du mélange.