Verbeterde productie van plasmiden: 21-voudige toename van plasmiden

In dit werk werd een plasmideproductieproces uitgevoerd waarbij conventionele erlenmeyers met LB-medium en het Thomson Ultra Yield®-systeem werden vergeleken. E. coli-cellen werden in beide systemen gekweekt in een rondschudapparaat (Multitron, INFORS HT), de bacteriegroei werd gecontroleerd en de plasmiden werden gezuiverd aan het einde van de kweek. Vervolgens werd de kwaliteit van de geïsoleerde plasmiden geanalyseerd met HPLC. De combinatie van de Ultra Yield®-flessen met het verrijkte Plasmid+®-medium en de AirOtop®-verbeterde afdichting leidde tot hogere celdichtheden en een 21-maal hogere hoeveelheid plasmide dan in Erlenmeyer-schudflessen met LB-medium.

Inleiding
De vraag naar plasmide DNA (pDNA) is de afgelopen jaren toegenomen als gevolg van de grote vraag naar gentherapieën en DNA-vaccinaties (pDNA wordt vaak gebruikt vanwege de hoge veiligheid). Daarom is er veel vraag naar een verhoogde productie van pDNA met een kosteneffectief, reproduceerbaar en betrouwbaar zuiverings- en kwaliteitscontrolesysteem. Plasmiden worden meestal geproduceerd in Escherichia coli (E. coli) cellen en vervolgens geïsoleerd door middel van een reeks zuiveringsstappen. Hoewel E. coli voornamelijk de compactere supercoiled (SC) plasmide DNA (pDNA) isovorm produceert, zijn open circulaire (OC), vernauwde, lineaire en gedenatureerde pDNA-isovormen meestal ook aanwezig. Het voorkomen van verschillende isovormen kan worden veroorzaakt door conformatieveranderingen die optreden in de bacteriële gastheer en tijdens de verwerking van biomassa (bijv. cellyse) en plasmidezuiveringsstappen [1]. Er zijn verschillende aanwijzingen dat hoge SC-niveaus nodig zijn om een effectieve immuunrespons op te wekken en uiteindelijk bescherming te bieden tegen infecties [2,3]. Bovendien is de SC pDNA-isovorm de gewenste isovorm voor transfectie, omdat deze een hogere transfectie-efficiëntie mogelijk maakt door de compactere verpakking in vergelijking met de OC- of lineaire varianten [4-6].
Anionenwisselingschromatografie (AEC) is een gebruikelijke methode om SC pDNA te zuiveren van andere plasmide-isovormen en om aanwezige onzuiverheden afkomstig van het gastorganisme te verwijderen. Idealiter levert het upstreamproductieproces al overwegend SC pDNA van hoge kwaliteit.
Materialen en methoden
Transformatie en teelt
Het pCMV3-GFP-plasmide (6883 bp) met een ampicillineresistentiegen (Sino Biological) werd getransformeerd in NEB 5-alpha competente E. coli-cellen (New England Biolabs) volgens het protocol van de fabrikant. De transformatiemix werd uitgeplaat op een selectieplaat (LB agar met 100 µg/mL ampicilline) en overnacht geïncubeerd bij 37°C. Er werd één kolonie uit de selectieplaat gekozen en er werd een overnachtingscultuur bereid in een glazen erlenmeyer van 500 ml zonder schotten met 50 ml LB-medium (trypton 10 g/L, gistextract 5 g/L, NaCl 10 g/L, pH 7,0 ± 0,2) met 100 µg/mL ampicilline. De kolf werd afgesloten met aluminiumfolie en werd geïncubeerd bij 37 °C en 180 min -1 in een orbitaal incubatieschudapparaat met Sticky Stuff kleefmatten (INFORS HT Multitron Incubator Shaker, 25 mm schudworp) gedurende de nacht (ten minste 18 uur). Voor de hoofdcultuur werden triplo's van 250 ml ongebaffelde glazen erlenmeyers met 25 ml LB met 100 µg/mL ampicilline bereid, wat wordt beschouwd als een standaard kweekopzet.
Drievoudige Ultra Yield®-kolven van 250 ml (Thomson, P/N: 931144) met 100 ml Plasmid+®-medium (Thomson, P/N: 446300) met 100 µg/mL ampicilline en 0,02% Antifoam 204 (Sigma-Aldrich) werden bereid. Zowel het standaardkweeksysteem als het Thomson-kweeksysteem werden geënt vanuit de nachtkweek, met een start-OD600nm van 0,2. De Ultra Yield®-flessen werden afgesloten met de AirOtop® Enhanced Seal (Thomson, P/N: 899423) en de erlenmeyers met aluminiumfolie. De kolven werden geïncubeerd bij 37 °C bij 350 min -1 of 180 min -1 in de INFORS HT Multitron Incubator Shaker (25 mm schudworp) met kolfklemmen. Let op: Sticky Stuff kleefmatten zijn niet geschikt voor 350 min -1 en het gebruik van klemmen is verplicht. De culturen werden gedurende ten minste 24 uur gekweekt en er werden regelmatig monsters genomen om de OD600nm in de loop van de tijd te meten.
DNA zuivering
Het PureYield™ Plasmid Miniprep System (Promega) werd gebruikt voor plasmidezuivering. LB-celsuspensie werd onverdund gebruikt, Thomson-celsuspensies werden 9-voudig verdund om ongeveer overeen te komen met de OD-waarde van LB-monsters. Van elke celsuspensie werd 600 µL monster genomen, dat vervolgens werd gecentrifugeerd en de pellet werd geresuspendeerd in 600 µL nucleasevrij water. Alle andere vervolgstappen werden uitgevoerd in overeenstemming met het PureYield™ Plasmid Miniprep System quick protocol FB093 voor kit A1223 of A1222. De DNA-zuivering werd uitgevoerd met de centrifugatiemethode. De plasmiden werden geëlueerd met nucleasevrij water dat bij de kit werd geleverd. De DNA-concentratie en zuiverheid van de geëlueerde monsters werden gemeten bij 230, 260 en 280 nm met een NanoDrop™ 2000/2000c spectrofotometer (Thermo Fisher Scientific).
Plasmide-analyse met HPLC
Voor plasmide-analyse werd een HPLC 1100 Series (Agilent) met DAD-detector 1100 Series (Agilent, G1315B) bij 260 nm gebruikt. De monsters werden gemeten op een BioPro IEX QF, 100 x 4,6 mm, 5 µm deeltjesgrootte kolom (YMC, QF00S05-1046WP). Er werd 5 µL van elk monster geïnjecteerd en gemeten in drievoud. De kolomtemperatuur werd ingesteld op 35 °C. Mobiele fase A (20 mM Tris-HCl, pH 7,4) en mobiele fase B (20 mM Tris-HCl, 1 M NaCl, pH 7,4) werden gebruikt om het monster te elueren in een gradiëntmethode met een constante stroom van 0,5 mL/min. De gradiënt werd uitgevoerd van minuut 0 tot minuut 0,7 met mobiele fase A (MPA) op 25% en mobiele fase B (MPB) op 75%. Vanaf minuut 0,7 werd de gradiënt toegepast en de samenstelling van 75% MPB werd gedurende 20 minuten tot minuut 20,7 gewijzigd in 100% en werd tot minuut 24 op 100% gehouden. In minuut 24,01 werd de samenstelling gewijzigd in 25% MPA en 75% MPB tot minuut 30 (einde van de injectie).
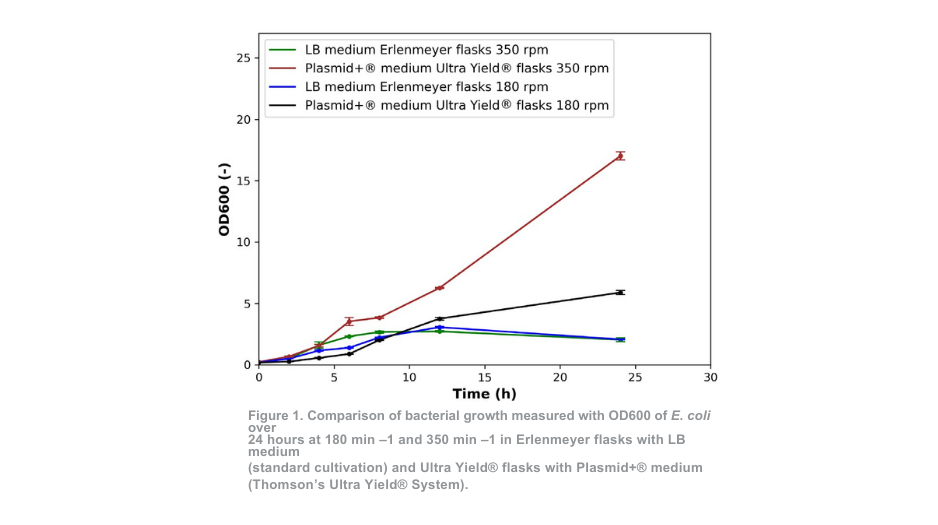
De bacteriële groei in erlenmeyers met LB-medium (standaardkweek) bij 350 min-1 en Ultra Yield®-flesjes met Plasmid+®-medium bij 350 min -1 vertoonde vergelijkbare patronen tot 4 uur kweek, zoals weergegeven in figuur 1. Voor de kweek bij 180 min -1 vertoonden de groeipatronen een vergelijkbaar patroon. Voor kweek bij 180 min -1 zijn de gelijkenissen zichtbaar tot 8 uur. In het geval van bacteriegroei in Ultra Yield®-kolven is de initiële groeisnelheid iets lager gedurende de eerste paar uur vergeleken met de standaardkweek.
Na 4 uur (350 min -1) en 8 uur (180 min -1) wordt echter een duidelijk contrast tussen de twee kweekomstandigheden zichtbaar. Bij de standaard kweekmethode is de optische dichtheid lager dan bij de meting na 12 uur, wat aangeeft dat het aantal levensvatbare cellen op dit tijdstip al afneemt. Aan het einde van de kweekperiode overtroffen de OD-waarden van het Ultra Yield®-systeem dat op 180 min-1 en 350 min-1 werd gehouden die van het standaardkweeksysteem met respectievelijk meer dan het 2-voudige en 7-voudige.
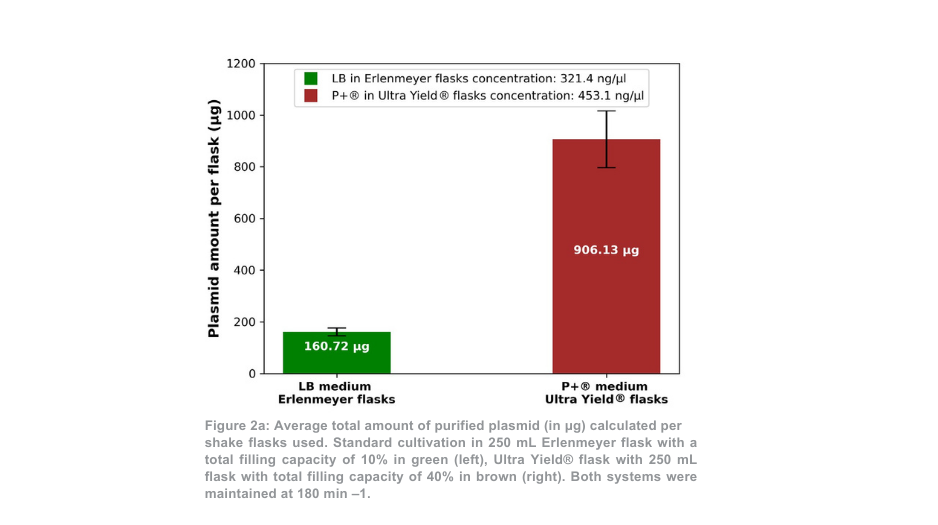
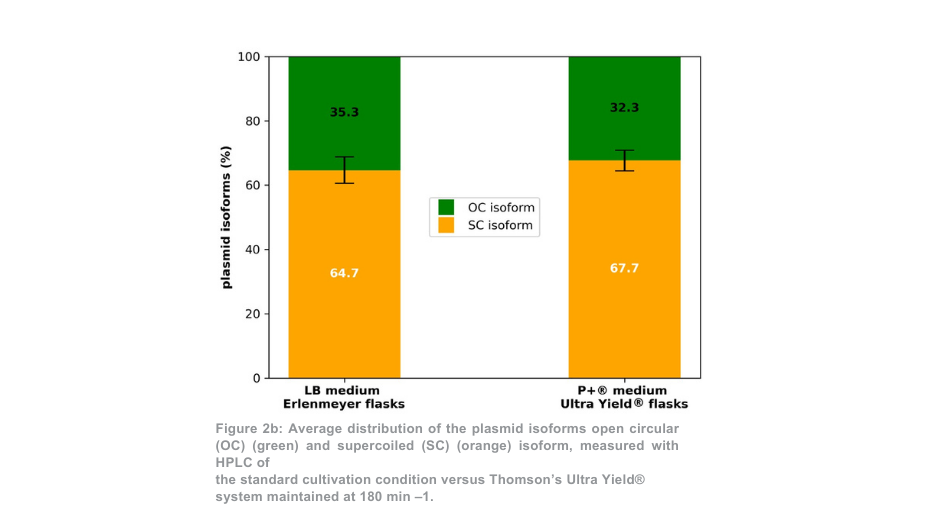
Na plasmide zuivering, de totale plasmide opbrengst voor de 180 min -1 voorwaarde was meer dan 5-voudig hoger per Thomson kolf in vergelijking met de Erlenmeyer kolven (Figuur 2a). Wanneer het volume verschil tussen kolven werd rekening gehouden, de plasmide opbrengst was 1,4-voudig hoger met de Thomson teeltsysteem versus de standaard teeltsysteem. Het aandeel supergecoild plasmide ten opzichte van open gecoild plasmide (Figuur 2b) was vergelijkbaar tussen het Thomson-teeltsysteem (67,7% supergecoild) en het standaardteeltsysteem (64,7% supergecoild).
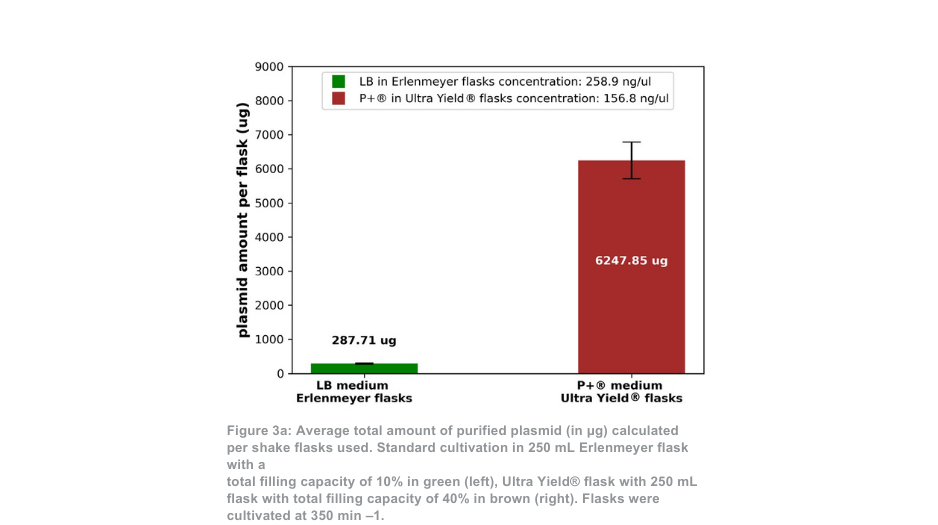
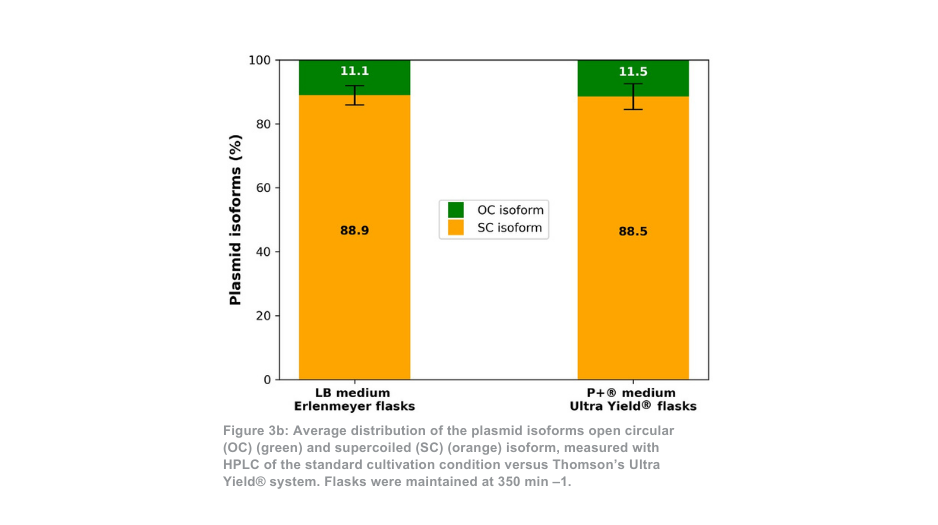
Het verschil tussen het Thomson-teeltsysteem en het standaardteeltsysteem is duidelijker wanneer het systeem op 350 min -1 wordt gehouden. In dit geval is de totale hoeveelheid gezuiverd plasmide per kolf ongeveer 21 keer zo groot met het Ultra Yield®-systeem van Thomson in vergelijking met de standaard kweekconditie, of ongeveer 5 keer zo groot als rekening wordt gehouden met het volumeverschil (figuur 3a). De verhouding supergecoild plasmide ten opzichte van open gecoild plasmide (afbeelding 3b) was opnieuw vergelijkbaar tussen het Thomson-teeltsysteem (88,5% supergecoild) en het standaardteeltsysteem (88,9% supergecoild).
Conclusie
De gegevens tonen aan dat de gebruikelijke schudsnelheden van 180 min -1 (baan van 25 mm) niet voldoende zijn voor een optimale celgroei in de Thomson Ultra Yield® flessen. Een hoge schudsnelheid van 350 min -1 zorgt voor een 3-voudige toename van de biomassa-opbrengst in vergelijking met 180 min -1. Met een betere celgroei werd een hogere pDNA-productie bereikt. Het succes van deze toepassing is sterk afhankelijk van het handhaven van een hoge roersnelheid om effectieve menging en gasoverdracht te bereiken, wat leidt tot een hogere opbrengst. Als de agitatiesnelheden toenemen van 180 min -1 tot 350 min -1, is er een 4-voudige toename van de kinetische energie die nodig is om het oppervlak effectief te schudden. Het is essentieel dat de belastingslimiet van de schudder de kolven bij hoge snelheden veilig kan dragen. De INFORS HT Multitron Incubator Shaker kan 45 x 250 ml kolven bevatten, met een media- en kweekmassa van in totaal 4,5 kilogram. Rekening houdend met de extra massa van de tray en de flasklemmen, zou de minimale belasting van de shaker meer dan 12 kilogram moeten zijn. Met grotere kolven is het mogelijk om meer dan 10 liter media in het schudapparaat te laden, waardoor de fysieke belastingslimiet en de binnenafmetingen van het schudapparaat extreem belangrijk worden. Al deze factoren benadrukken de noodzaak van een robuuste schudder, zoals de Multitron Incubator Shaker, om de voordelen van dit proces volledig te realiseren.
De combinatie van de Ultra Yield®-flessen met het verrijkte Plasmid+®-medium en de AirOtop® verbeterde afdichting leidde tot hogere celdichtheden en een 21-maal hogere hoeveelheid plasmide dan in Erlenmeyer-schudflessen met LB-medium. De algehele hogere opbrengst aan plasmiden resulteert ook in een grotere hoeveelheid van de supercoiled (SC) plasmide isovorm die gewenst is voor transfectie van zoogdiercellen [4,5]. Rekening houdend met de totale eigendomskosten van een plasmideproductieproces in het laboratorium, is het gebruik van Thomson Ultra Yield® kolven, Plasmid+® medium in combinatie met een krachtige incubatieschudder op 350 min -1 goedkoper in plasmide mg/L in vergelijking met LB-teelt in glazen Erlenmeyers. Investeren in een goede shaker om hogere snelheden te bereiken en Thomson System is voordelig.
Gebruik AIROTOP® Seal/Vented Screw Cap Media mL/Flask Shaker Snelheid (RPM)
| Code | Beschrijving | Gebruik AIROTOP® afdichting/geventileerde schroefdop | Media mL/Fles | Schuddersnelheid (RPM) | |
| 931147 | 125 ml Ultra Yield®-flessen 50/CS - Steriel | 899421 / 899109 | 35-50 mL/Flask | 300-350 | |
| 931144 | 250 ml Ultra Yield®-flessen 50/CS - Steriel | 899423 / 899110 | 75-100 mL/Flask | 300-350 | |
| 931141 | 500 ml Ultra Yield®-flessen 25/CS - Steriel | 899424 / 899111 | 150-200 mL/Flask | 300-350 | |
| 931138 | 1.5L Ultra Yield® flessen 12/CS - Steriel | 899425 / 899566 | 300 mL/Flask | 300-350 | |
| 931136-B | 2.5L Ultra Yield® flessen 6/CS - Steriel | 899425 / 899566 | 500 mL/Flask | 300-400 | |
| 446300 | Plasmid+® Verrijkte Media - Steriel | N/A | N/A | N/A |
Referenties
- D.M. Prazeres, T. Schluep, C. Cooney, Preparatieve zuivering van supergewikkeld plasmide DNA met behulp van anionenwisselingschromatografie, J. Chromatogr. A 806 (1998) 31–45. https://doi.org/10.1016/s0021-9673(97)01254-5.
- Lionel Cupillard, Véronique Juillard, Sophie Latour, Guy Colombet, N. Cachet, S. Richard, S. Blanchard, Laurent Fischer, Invloed van supercoiling van plasmiden op de werkzaamheid van een DNA-vaccin tegen hondsdolheid ter bescherming van katten, Vaccin 23 (2005) 1910–1916. https://doi.org/10.1016/J.VACCINE.2004.10.018.
- 3. Huangjin Li, Huaben Bo, Jinquan Wang, Hongwei Shao, Shulin Huang, Scheiding van supercoiled van open circulaire vormen van plasmide DNA en detectie van biologische activiteit, Cytotechnologie 63 (2011) 7–12. https://doi. org/10.1007/s10616-010-9322.
- Christof Maucksch, Alexander Bohla, Florian Hoffmann, Martin Schleef, Manish Kumar Aneja, Markus Elfinger, Dominik Hartl, Carsten Rudolph, Transgene expressie van getransfecteerd supercoiled plasmide DNA concatemers in zoogdiercellen, Tijdschrift voor Geneeskunde 11 (2009) 444–453. https://doi.org/10.1002/jgm.1310.
- Arjun Dhanoya, Benjamin M. Chain, Eli Keshavarz-Moore, De invloed van DNA-topologie op polyplexopname en transfectie-efficiëntie in zoogdiercellen, Tijdschrift voor biotechnologie 155 (2011) 377–386. https://doi.org/10.1016/J.JBIOTEC.2011.07.023.
- Fani Sousa, Duarte M.F. Prazeres, João A. Queiroz, Verbetering van de transfectie-efficiëntie door gebruik van supergewikkeld plasmide DNA gezuiverd met arginineaffiniteitschromatografie, Tijdschrift voor Geneeskunde 11 (2009) 79–88. https://doi.org/10.1002/JGM.1272.

