Systèmes CRISPR-Cas : Révolutionner la technologie d'édition du génome

CRISPR-Cas9 : Révolutionner l’édition génomique avec précision pour des avancées en médecine, agriculture et bien plus.

La découverte de CRISPR (Courtes Répétitions Palindromiques Regroupées et Régulièrement Espacées) et de ses protéines Cas associées a démocratisé l'édition du génome, offrant une précision et une polyvalence sans précédent. Initiée par les travaux fondamentaux de Doudna et Charpentier (2012), CRISPR-Cas9 exploite un mécanisme de défense bactérien pour créer des cassures ciblées double brin dans l'ADN, permettant une inactivation ou une insertion génique efficace via la réparation dirigée par homologie (HDR). Depuis lors, les systèmes CRISPR se sont diversifiés, avec des innovations telles que les éditeurs de base, les éditeurs "prime", et l'interférence CRISPR (CRISPRi/a) élargissant la boîte à outils pour l'ingénierie précise du génome.
Les systèmes CRISPR-Cas fonctionnent via un mécanisme à deux composants où l'ARN guide (gRNA) dirige l'endonucléase Cas9 vers un emplacement génomique spécifique, entraînant des cassures double brin (DSBs) (Zakrzewska et Burmistrz, 2023). Ces cassures sont ensuite réparées soit par jonction d'extrémités non homologues (NHEJ), soit par réparation dirigée par homologie (HDR), permettant une édition génique précise (Zakrzewska et Burmistrz, 2023). L'ensemble du processus peut être divisé en trois étapes : reconnaissance, clivage et réparation (Asmamaw et Zawdie, 2021). Initialement, le complexe Cas9 : sgRNA se lie à l'ADN (Bhattacharya et Satpati, 2022). L'ARNcr mature est incorporé dans le complexe effecteur et recherche des séquences complémentaires à son fragment espaceur (Zakrzewska et Burmistrz, 2023). Pour les systèmes de Classe 2 Type II, le complexe protéique Cas9, ainsi que l'ARNcr mature et l'ARN tracr, analysent l'ADN à la recherche d'un motif adjacent au protospacer (PAM) (Zakrzewska et Burmistrz, 2023). La reconnaissance de la séquence complémentaire induit une structure de boucle R, conduisant à un clivage double brin via les domaines HNH et RuvC (Zakrzewska et Burmistrz, 2023).
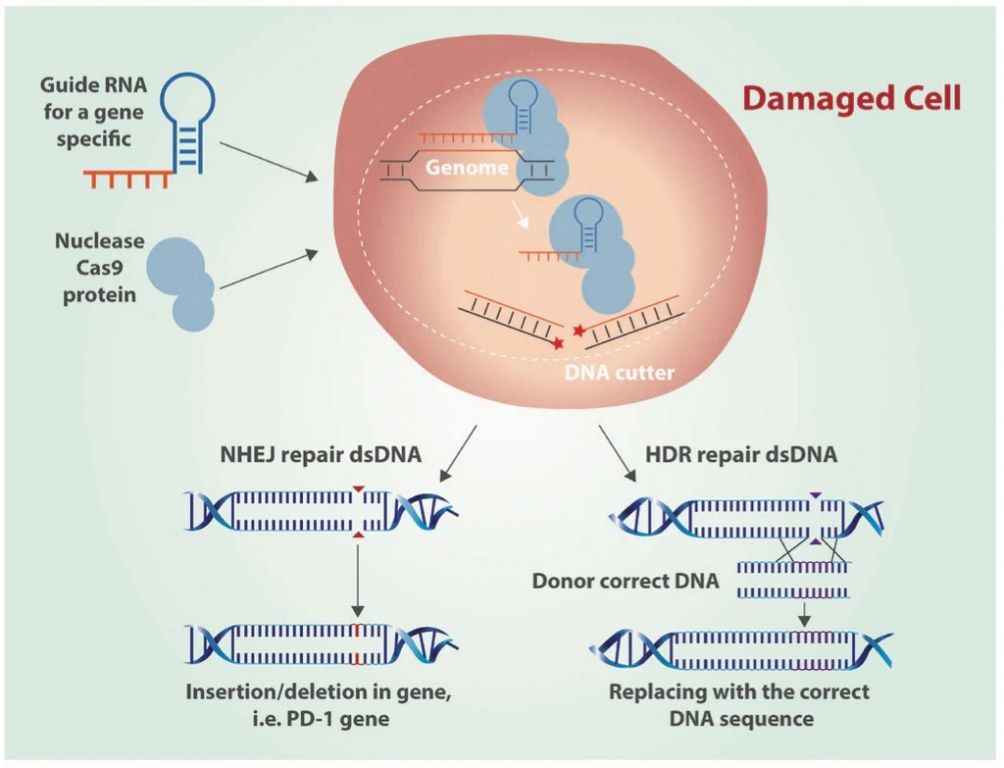
Figure 1 : Édition génique de l'ADN par CRISPR Cas9 utilisant la jonction d'extrémités non homologues (NHEJ) et la réparation dirigée par homologie (HDR) (Castillo, 2016).
Applications
Thérapie génique
L'une des applications les plus prometteuses de la technologie CRISPR-Cas réside dans la thérapie génique. En ciblant directement les mutations génétiques responsables de maladies, les chercheurs peuvent potentiellement corriger ces anomalies à la source. Parmi les succès notables, on peut citer l'édition du gène CCR5 dans les lymphocytes T humains pour conférer une résistance à l'infection par le VIH (Zhu, 2022). De plus, CRISPR a été utilisé pour développer des modèles murins qui imitent les maladies humaines, facilitant ainsi l'étude des mécanismes physiopathologiques et des stratégies thérapeutiques (Cribbs et Perera, 2017).
Médecine de précision
La capacité de CRISPR à éditer les gènes avec précision ouvre de nouvelles voies pour la médecine personnalisée. En adaptant les traitements en fonction de la constitution génétique d'un individu, CRISPR peut améliorer l'efficacité thérapeutique tout en minimisant les effets indésirables. Par exemple, la recherche actuelle explore son application dans la thérapie contre le cancer en ciblant les oncogènes et les gènes suppresseurs de tumeurs pour inhiber la croissance tumorale (Zhu, 2022).
Biotechnologie agricole
Au-delà de la santé humaine, les systèmes CRISPR-Cas révolutionnent les pratiques agricoles. Cette technologie permet le développement de cultures aux caractéristiques améliorées, telles que la résistance aux maladies, la tolérance à la sécheresse et l'amélioration des profils nutritionnels. Cette avancée biotechnologique promet de relever les défis de la sécurité alimentaire posés par le changement climatique et la croissance démographique (Zhu, 2022).
Les systèmes CRISPR-Cas représentent une avancée révolutionnaire dans le domaine de l'ingénierie génétique, avec des implications considérables dans divers domaines. Alors que la recherche continue de dévoiler tout le potentiel de cette technologie, il est impératif que les scientifiques adoptent des pratiques responsables qui donnent la priorité à la sécurité et aux considérations éthiques. L'avenir de la biologie de précision dépend de notre capacité à exploiter ces outils puissants tout en surmontant les complexités qu'ils présentent.
En résumé, la technologie CRISPR-Cas est à l'avant-garde de l'innovation scientifique, offrant des solutions transformatrices pour les maladies génétiques et les défis agricoles. L'exploration continue et le dialogue autour de ses applications seront cruciaux à mesure que nous avançons vers un avenir où l'édition génétique précise deviendra une pratique courante en médecine et en biotechnologie.
Références
Doudna, J.A. and Charpentier, E., 2014. The new frontier of genome engineering with CRISPR-Cas9. Science, 346(6213), p.1258096.
Zakrzewska, M. and Burmistrz, M., 2023. Mechanisms regulating the CRISPR-Cas systems. Frontiers in Microbiology, 14, p.1060337.
Asmamaw, M. and Zawdie, B., 2021. Mechanism and applications of CRISPR/Cas-9-mediated genome editing. Biologics: targets and therapy, pp.353-361.
Bhattacharya, S. and Satpati, P., 2022. Insights into the mechanism of CRISPR/Cas9-based genome editing from molecular dynamics simulations. ACS omega, 8(2), pp.1817-1837.
Castillo, A., 2016. Gene editing using CRISPR-Cas9 for the treatment of lung cancer. Colombia Médica, 47(4), pp.178-180.
Zhu, Y., 2022. Advances in CRISPR/Cas9. BioMed research international, 2022(1), p.9978571.
Cribbs, A.P. and Perera, S.M., 2017. Focus: Genome editing: Science and bioethics of CRISPR-Cas9 gene editing: An analysis towards separating facts and fiction. The Yale journal of biology and medicine, 90(4), p.625.

